Boyle yasası
Boyle yasası (Mariotte yasası ve Boyle-Mariotte yasası olarak da adlandırılır) ideal gazlarla ilgili bir yasadır.
Kanun şu şekilde ifade edilebilir:
Sabit bir sıcaklıkta tutulan ideal bir gazın sabit bir miktarı için, P (basınç) ve V (hacim) ters orantılıdır.
Başka bir deyişle, sabit bir sıcaklıktaki sabit bir ideal gaz kütlesinin hacmi, üzerine uygulanan basınçla ters orantılıdır.
Sembollerde, kanun şöyledir:
P ∝ 1 V {\displaystyle P\propto {\frac {1}{V}}}
veya
P V = k {\displaystyle PV=k}
Burada P gazın basıncı, V gazın hacmi ve k ise bir sabittir.
Sabit bir sıcaklıkta belirli bir gaz kütlesi için basınç ve hacmin çarpımı bir sabittir. Hacim azaldıkça, basınç orantılı olarak artar ve bunun tersi de geçerlidir. Örneğin, basınç yarıya indiğinde hacim iki katına çıkar.
Belirli bir basınçta belirli bir hacimde gaz içeren bir tankınız olduğunu varsayalım. Tankın hacmini azalttığınızda, aynı sayıda gaz parçacığı artık daha küçük bir alanda bulunur. Bu nedenle çarpışma sayısı artar. Bu nedenle basınç daha yüksektir.
Belirli bir basınçta (P1 ) ve hacimde (V1 ) bir gazınız olduğunu düşünün. Basıncı yeni bir değere (P2 ) değiştirirseniz, hacim de yeni bir değere (V2 ) değişir. Her iki koşul kümesini tanımlamak için Boyle yasasını kullanabiliriz:
P 1 V 1 = k {\displaystyle P_{1}V_{1}=k}
P 2 V 2 = k {\displaystyle P_{2}V_{2}=k}
Sabit, k, her iki durumda da aynıdır, bu nedenle aşağıdakileri söyleyebiliriz:
P 1 V 1 = P 2 V 2 {\displaystyle P_{1}V_{1}=P_{2}V_{2}}
Örnek: Bir gazın basıncı 3 atm ve hacmi 5 litredir. Basınç 2 atm'ye düşürülürse hacim ne olur?
P 1 V 1 = P 2 V 2 {\displaystyle P_{1}V_{1}=P_{2}V_{2}}
V 2 = P 1 V 1 P 2 {\displaystyle V_{2}={\frac {P_{1}V_{1}}{P_{2}}}}
V 2 = 3 ∗ 5 2 {\displaystyle V_{2}={\frac {3*5}{2}}}
V 2 = 15 2 {\displaystyle V_{2}={\frac {15}{2}}}
V 2 = 7,5 {\displaystyle V_{2}=7,5}
∴ Hacim 7,5 litre olacaktır.
Yasa 1662 yılında Robert Boyle tarafından ve daha sonra bağımsız olarak 1679 yılında Edme Mariotte tarafından bulunmuştur.
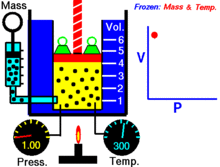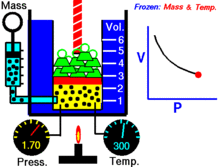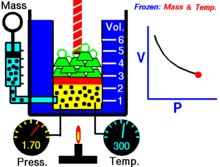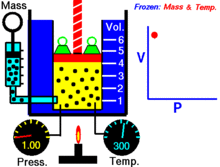
Basınç ve hacim arasındaki ilişkiyi gösteren bir animasyon Gazın miktarı ve sıcaklığı sabittir.
Sorular ve Yanıtlar
S: Boyle yasası nedir?
C: Boyle yasası (Mariotte yasası ve Boyle-Mariotte yasası olarak da adlandırılır), sabit bir sıcaklıkta tutulan ideal bir gazın sabit bir miktarı için basınç (P) ve hacmin (V) ters orantılı olduğunu belirten ideal gazlarla ilgili bir yasadır.
S: Boyle Yasasını matematiksel olarak nasıl ifade edebiliriz?
C: Boyle Yasasını matematiksel olarak P ∝ 1/V veya PV = k şeklinde ifade edebiliriz; burada P gazın basıncı, V gazın hacmi ve k bir sabittir.
S: Bu yasayı kim keşfetti?
C: Yasa 1662 yılında Robert Boyle tarafından ve daha sonra bağımsız olarak 1679 yılında Edme Mariotte tarafından bulunmuştur.
S: P ve V'nin ters orantılı olduğunu söylediğimizde bu ne anlama gelir?
C: Bu, biri arttıkça diğerinin orantılı olarak azaldığı anlamına gelir - yani belirli bir basınçta belirli miktarda gaz içeren bir tankın hacmini azaltırsanız, daha az alanda bulunmaktan kaynaklanan parçacıklar arasındaki çarpışmaların artması nedeniyle basınç artacaktır.
S: Basınç veya hacimdeki değişiklikleri hesaplamak için Boyle Yasasını nasıl kullanırız?
C: Boyle Yasasını basınç veya hacimdeki değişiklikleri hesaplamak için iki denklem kullanarak kullanabiliriz - P1V1=k ve P2V2=k - burada k sabit kalırken P1/V1 veya P2/V2 hesaplamaya çalıştığınız şeye bağlı olarak değişir.
S: Bu yasayı gerçek gazlara da uygulayabilir miyiz?
C: Hayır - bu sadece ideal gazlar için geçerlidir çünkü aralarında moleküller arası kuvvetler yoktur.
Ansiklopedi içinde ara








