pH
pH, 0 ila 14 arasında bir asitlik ölçeğidir. Bir maddenin ne kadar asidik veya alkalin olduğunu gösterir. Daha asidik çözeltiler daha düşük pH değerine sahiptir. Daha alkali çözeltiler daha yüksek pH değerine sahiptir. Asidik veya alkali olmayan maddelerin (yani nötr çözeltilerin) pH değeri genellikle 7'dir. Asitlerin pH değeri 7'den düşüktür. Alkalilerin pH değeri 7'den büyüktür.
pH, bir çözeltideki proton (H+ ) konsantrasyonunun bir ölçüsüdür. S.P.L. Sørensen bu kavramı 1909 yılında ortaya atmıştır. P, Almancada güç veya konsantrasyon anlamına gelen potenz'i, H ise hidrojen iyonunu (H+ ) ifade etmektedir.
pH'ı hesaplamak için en yaygın formül şudur:
pH = - log 10 [ H + ] {\displaystyle {\mbox{pH}}=-\log _{10}\left[{\mbox{H}}^{+}\right]}
+ [H], litre başına mol cinsinden ölçülen (molarite olarak da bilinir) H+ iyonlarının konsantrasyonunu gösterir (aynı zamanda [H3 O+ ], hidronyum iyonlarının eşit konsantrasyonu olarak da yazılır).
Ancak, doğru denklem aslında şudur:
pH = - log 10 [ a H + ] {\displaystyle {\mbox{pH}}=-\log _{10}\left[a_{\mathrm {H^{+}} }\right]}
burada a H + {\displaystyle a_{\mathrm {H^{+}} }}
Çoğu madde 0 ila 14 aralığında bir pH değerine sahiptir, ancak aşırı asidik veya alkali maddeler pH < 0 veya pH > 14 olabilir.
Alkali maddeler hidrojen iyonları yerine hidroksit iyonları konsantrasyonuna sahiptir (OH- ).
pH göstergeleri
Bazı boyalar, asit çözeltisinde veya alkali çözeltisinde olmalarına bağlı olarak renk değiştirir. pH indikatörü, çözeltinin pH'ının (asitlik veya bazlık) görülebilmesi için bir çözeltiye az miktarda eklenen kimyasal bir bileşiktir. pH indikatörü, hidronyum iyonları (H3 O+ ) veya hidrojen iyonları (H+ ) için kimyasal bir detektördür. Normalde indikatör, pH değerine bağlı olarak çözeltinin renginin değişmesine neden olur.
Tipik indikatörler fenolftalein, metil turuncu, metil kırmızı, bromotimol mavisi ve timol mavisidir. Her biri pH ölçeğinde farklı noktalarda renk değiştirir ve evrensel bir indikatör olarak birlikte kullanılabilirler.
Bir başka yol da doğal pH göstergelerine dayanan turnusol kağıdı kullanmaktır. Kağıt size kimyasalın ne kadar güçlü olduğunu, daha güçlü bir asit mi yoksa daha güçlü bir baz mı olduğunu söyleyebilir.
Bazı yaygın pH değerleri
| pH | |
| Akü asidi | 0 |
| Gastrik asit | 1.0 |
| Limon suyu | 2.4 |
| Kola | 2.5 |
| Oksijenli su | 2.5 - 3.0 |
| Sirke | 3.0 |
| Portakal veya elma suyu | 3.0 |
| Bira | 4.5 |
| Kahve | 5.0 |
| Süt | 6.6 |
| 7.0 | |
| Kan | 7.35 - 7.45 |
| Sade şampuan | 8.0 |
| Deniz suyu | 8.0 |
| Kalıcı dalga | 8.5 - 9.2 |
| El sabunu | 9.0 - 10.0 |
| Saç boyası | 9.5 - 10.5 |
| Sihirli düz | 11.5 |
| Ev tipi amonyak | 11.5 |
| Çamaşır Suyu | 12.3 |
| Kostik soda | 12.7 |
| Ev tipi kül suyu | 13.5 |
| Drenaj Temizleyici | 14 |
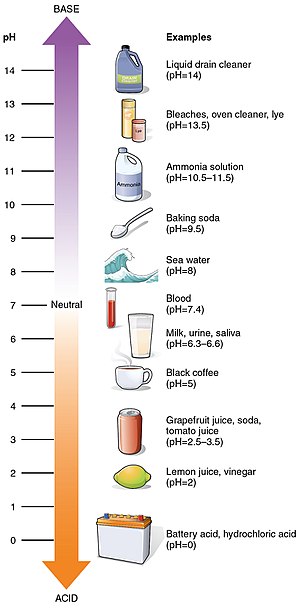
Bazı yaygın maddelerin pH değerleri
Nötralizasyon
Nötralizasyon denklem ile özetlenebilir:
H+
+ OH−
→ H
2O
İlgili sayfalar
Sorular ve Yanıtlar
S: pH nedir?
C: pH, bir çözeltideki proton (H+) konsantrasyonunu ölçen 0 ila 14 arasında bir asitlik ölçeğidir. Bir maddenin ne kadar asidik veya alkali olduğunu gösterir; daha asidik çözeltiler daha düşük pH değerine, daha alkali çözeltiler ise daha yüksek pH değerine sahiptir. Nötr çözeltilerin pH değeri genellikle 7'dir.
S: pH kavramını kim ortaya atmıştır?
C: S.P.L. Sørensen bu kavramı 1909 yılında ortaya atmıştır.
S: "pH "daki "p" ne anlama gelir?
C: "p", güç veya konsantrasyon anlamına gelen Almanca potenz kelimesinin kısaltmasıdır.
S: pH nasıl hesaplanır?
C: pH'ı hesaplamak için en yaygın formül, litre başına mol (veya molarite) cinsinden ölçülen H+ iyonları konsantrasyonunun (eşit hidronyum iyonu konsantrasyonlarını gösteren [H3O+] olarak da yazılır) 10 katının negatif logaritmasını almaktır. Bununla birlikte, sadece konsantrasyon yerine aktiviteyi de hesaba katan bir denklem de vardır ve duruma bağlı olarak daha yaygın olan formülden farklı değerler sağlayabilir.
S: Çoğu madde pH ölçeğinde hangi aralığa sahiptir?
C: Çoğu maddenin pH değeri 0 ile 14 arasındadır, ancak aşırı asidik veya alkali maddeler bu aralığın dışında bir değere sahip olabilir (0'dan küçük veya 14'ten büyük).
S: Alkali maddeler pH ölçeğinde asidik maddelerden nasıl farklıdır? C: Alkali maddeler, asitler gibi hidrojen iyonları yerine hidroksit iyonları (OH-) konsantrasyonları nedeniyle ölçekte daha yüksek değerlere sahiptir.
Ansiklopedi içinde ara
![{\displaystyle {\mbox{pH}}=-\log _{10}\left[{\mbox{H}}^{+}\right]}](https://www.alegsaonline.com/image/093977a79b6a17e02db4699475930e48c05d6468.svg)
![{\displaystyle {\mbox{pH}}=-\log _{10}\left[a_{\mathrm {H^{+}} }\right]}](https://www.alegsaonline.com/image/7a631c4037415f3d4483a6cb07e69858b64890fc.svg)