Kimyasal reaksiyon
Bir kimyasal reaksiyon, bir veya daha fazla kimyasalın bir veya daha fazla başka kimyasala dönüşmesiyle gerçekleşir. Örnekler:
- demir ve oksijenin birleşerek pas oluşturması
- sirke ve kabartma tozu birleşerek sodyum asetat, karbondioksit ve su oluşturur
- yanan veya patlayan şeyler
- canlıların içinde gerçekleşen birçok reaksiyon
- aküleri boşaltırken veya şarj ederken elektrokimyasal reaksiyonlar
Bazı tepkiler hızlı, bazıları ise yavaştır. Bazıları sıcaklığa veya başka şeylere bağlı olarak farklı hızlarda gerçekleşir. Örneğin, ahşap soğukken hava ile reaksiyona girmez, ancak yeterince ısıtılırsa yanmaya başlar. Bazı reaksiyonlar enerji açığa çıkarır. Bunlar ekzotermik reaksiyonlardır. Diğer reaksiyonlarda ise enerji alınır. Bunlar endotermik reaksiyonlardır31401.
Nükleer reaksiyonlar kimyasal reaksiyonlar değildir. Kimyasal reaksiyonlar sadece atomların elektronlarını içerir; nükleer reaksiyonlar ise atom çekirdeğindeki proton ve nötronları içerir.

Paslanan demir

Şenlik ateşi redoks için bir örnektir
Dört temel tip
Sentez
Bir sentez reaksiyonunda, iki veya daha fazla basit madde birleşerek daha karmaşık bir madde oluşturur.
A + B ⟶ A B {\displaystyle A+B\longrightarrow AB}
"Bir ürün veren iki veya daha fazla reaktan" bir sentez reaksiyonunu tanımlamanın başka bir yoludur. Bir sentez reaksiyonu örneği, demir ve sülfürün demir (II) sülfür oluşturmak üzere birleşmesidir:
8 F e + S 8 ⟶ 8 F e S {\displaystyle 8Fe+S_{8}\longrightarrow 8FeS}
Bir başka örnek de basit hidrojen gazının basit oksijen gazı ile birleşerek su gibi daha karmaşık bir madde üretmesidir.
Ayrıştırma
Ayrışma reaksiyonu, daha karmaşık bir maddenin daha basit parçalarına ayrılmasıdır. Bu nedenle sentez reaksiyonunun tersidir ve şu şekilde yazılabilir:
A B ⟶ A + B {\displaystyle AB\longrightarrow A+B}
Bir ayrışma reaksiyonu örneği, oksijen ve hidrojen gazı yapmak için suyun elektrolizidir:
2 H 2 O ⟶ 2 H 2 + O 2 {\displaystyle 2H_{2}O\longrightarrow 2H_{2}+O_{2}}
Tekli değiştirme
Tekli yer değiştirme reaksiyonunda, birleşik olmayan tek bir element bir bileşikteki başka bir elementin yerini alır; başka bir deyişle, bir element bir bileşikteki başka bir elementle yer değiştirir Bu reaksiyonlar genel olarak şu şekildedir:
A + B C ⟶ A C + B {\displaystyle A+BC\longrightarrow AC+B}
Tek bir yer değiştirme reaksiyonuna örnek olarak magnezyumun suda hidrojenle yer değiştirerek magnezyum hidroksit ve hidrojen gazı oluşturması verilebilir:
M g + 2 H 2 O ⟶ M g ( O H ) 2 + H 2 {\displaystyle Mg+2H_{2}O\longrightarrow Mg(OH)_{2}+H_{2}}
Çift değiştirme
Çift yer değiştirme reaksiyonunda, iki bileşiğin anyon ve katyonları yer değiştirir ve tamamen farklı iki bileşik oluşturur. Bu reaksiyonlar genel formdadır:
A B + C D ⟶ A D + C B {\displaystyle AB+CD\longrightarrow AD+CB}
Örneğin, baryum klorür (BaCl2 ) ve magnezyum sülfat (MgSO4 ) reaksiyona girdiğinde, SO42− anyonu 2Cl− anyonu ile yer değiştirerek BaSO4 ve MgCl2 bileşiklerini verir.
Çift yer değiştirme reaksiyonuna bir başka örnek de kurşun(II) nitratın potasyum iyodür ile reaksiyona girerek kurşun(II) iyodür ve potasyum nitrat oluşturmasıdır:
P b ( N O 3 ) 2 + 2 K I ⟶ P b I 2 + 2 K N O 3 {\displaystyle Pb(NO_{3})_{2}+2KI\longrightarrow PbI_{2}+2KNO_{3}}
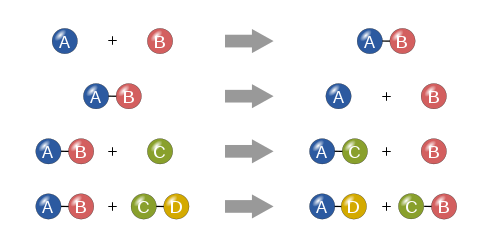
Dört temel kimyasal reaksiyon türü: sentez, ayrışma, tekli yer değiştirme ve çiftli yer değiştirme
Denklemler
Bir kimyasal reaksiyon bir denklemle gösteriliyor:
A + B ⟶ C + D {\displaystyle \mathrm {A+B\longrightarrow C+D} }
Burada, A ve B kimyasal bir reaksiyonla C ve D'ye dönüşür.
Bu bir yanma reaksiyonu örneğidir.
C + O 2 ⟶ C O 2 {\displaystyle \mathrm {C+O_{2}\longrightarrow CO_{2}} }
İlgili sayfalar
- Organik reaksiyon
- Redoks
Sorular ve Yanıtlar
S: Kimyasal reaksiyon nedir?
C: Bir kimyasal reaksiyon, bir veya daha fazla kimyasalın bir veya daha fazla başka kimyasala dönüşmesiyle gerçekleşir.
S: Kimyasal reaksiyonlara örnek verebilir misiniz?
C: Evet, demir ve oksijenin birleşerek pas oluşturması, sirke ve kabartma tozunun birleşerek sodyum asetat oluşturması, karbondioksit ve su, cisimlerin yanması veya patlaması ve fotosentez gibi canlıların içinde gerçekleşen birçok reaksiyon kimyasal reaksiyonlara örnek olarak verilebilir.
S: Tüm kimyasal reaksiyonlar hızlı mıdır?
C: Hayır, bazı reaksiyonlar hızlı, bazıları ise yavaştır. Bazıları sıcaklığa veya başka şeylere bağlı olarak farklı hızlarda gerçekleşir.
S: Ekzotermik reaksiyon nedir?
C: Ekzotermik bir reaksiyon enerji açığa çıkaran bir reaksiyondur.
S: Endotermik reaksiyon nedir?
C: Endotermik bir reaksiyon enerji alan bir reaksiyondur.
S: Nükleer reaksiyonlar kimyasal reaksiyon olarak kabul edilir mi?
C: Hayır, nükleer reaksiyonlar kimyasal reaksiyonlar değildir. Kimyasal reaksiyonlar sadece atomların elektronlarını içerir; nükleer reaksiyonlar ise atom çekirdeğindeki proton ve nötronları içerir.
S: Sıcaklık bir kimyasal reaksiyonun hızını etkileyebilir mi?
C: Evet, sıcaklığa veya başka şeylere bağlı olarak bazı reaksiyonlar farklı hızlarda gerçekleşebilir. Örneğin, odun soğukken hava ile tepkimeye girmez, ancak yeterince ısıtılırsa yanmaya başlar.
Ansiklopedi içinde ara









