Termokimya
Termokimya, kimyasal reaksiyonlar ve fiziksel dönüşümler (fiziksel değişimler) ile ilgili enerji ve ısının incelenmesidir. Fiziksel dönüşümler, maddenin bir halinin (örneğin katı veya sıvı) başka bir hale dönüşmesidir. Dönüşümlere örnek olarak erime (bir katının sıvıya dönüşmesi) ve kaynama (bir sıvının gaza dönüşmesi) verilebilir.
Bir reaksiyon enerji verir veya enerji alır. Fiziksel bir dönüşüm de enerji verir ya da alır. Termokimya bu enerji değişimlerini, özellikle de bir sistemin çevresiyle olan enerji alışverişini inceler. Termokimya, belirli bir reaksiyon sırasında her zaman reaktan ve ürün miktarlarını tahmin etmede yararlıdır. Termokimyacılar bunu entropi tayinleri de dahil olmak üzere verileri kullanarak yaparlar. Termokimyacılar bir reaksiyonun kendiliğinden mi yoksa kendiliğinden olmayan mı, elverişli mi yoksa elverişsiz mi olduğunu söyleyecektir.
Endotermik reaksiyonlar ısı alır. Ekzotermik reaksiyonlar ısı verir. Termokimya, termodinamik kavramları ile kimyasal bağlar şeklindeki enerji fikrini birleştirir. Isı kapasitesi, yanma ısısı, oluşum ısısı, entalpi, entropi, serbest enerji ve kalori gibi büyüklüklerin hesaplanmasını içerir.
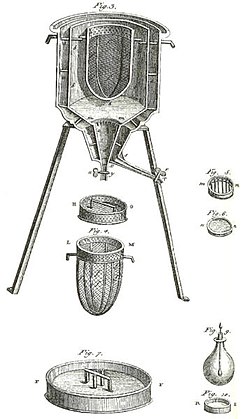
Dünyanın ilk buz kalorimetresi, 1782-83 kışında Antoine Lavoisier ve Pierre-Simon Laplace tarafından kullanılmıştır. Çeşitli kimyasal değişimlerde ortaya çıkan ısıyı bulmak için kullanılmıştır. Bu hesaplamalar Joseph Black'in daha önceki gizli ısı keşfine dayanıyordu. Bu deneyler termokimyayı başlatmıştır.
Tarih
Termokimya iki fikirle başladı:
- Lavoisier ve Laplace yasası (1780): Herhangi bir dönüşüm için enerji değişimi, ters işlem için enerji değişimine eşit ve zıttır.
- Hess Yasası (1840): Herhangi bir dönüşüm için enerji değişimi, ister tek adımda ister birçok adımda olsun aynıdır.
Bu keşifler termodinamiğin ilk yasasından (1845) önce gerçekleşmiştir. Bilim insanlarının bu yasayı anlamalarına yardımcı oldular.
Edward Diaz ve Hess özgül ısı ve gizli ısıyı araştırmıştır. Joseph Black gizli enerji değişimleri kavramını geliştirmiştir.
Gustav Kirchhoff 1858 yılında reaksiyon ısısındaki değişimin ürünler ve reaktanlar arasındaki ısı kapasitesi farkı ile verildiğini göstermiştir: ∂ Δ H ∂ T = Δ C p {\displaystyle {{\partial \Delta H} \over \partial T}=\Delta C_{p}} 
Kalorimetri
Isı değişimlerinin ölçümüne kalorimetri denir. Kimyasal reaksiyonların veya fiziksel değişimlerin ısısını ölçer. Kalorimetre, kalorimetri için kullanılan bir cihazdır ve genellikle kapalı bir haznesi vardır.
Kalorimetri şu adımlardan oluşur: Kimyagerler değişimin oda içinde gerçekleşmesini sağlar. Haznenin sıcaklığı bir termometre ya da termokupl kullanılarak ölçülür. Sıcaklık zamana karşı çizilerek bir grafik elde edilir. Kimyagerler grafiği temel miktarları hesaplamak için kullanır.
Modern kalorimetreler, sıcaklığı ölçen ve hesaplanan verileri hızlı bir şekilde veren küçük bilgisayarlara sahiptir. Buna bir örnek diferansiyel taramalı kalorimetredir (DSC).
Sistemler
Termokimyada birkaç termodinamik tanım çok kullanışlıdır. Bir "sistem", evrenin incelenen belirli bir bölümüdür. Sistemin dışındaki her şey çevre veya ortam olarak kabul edilir. Bir sistem şöyle olabilir:
- Yalıtılmış bir sistem - yalıtılmış bir bomba kalorimetresinde olduğu gibi çevresiyle enerji veya madde alışverişi yapamadığında;
- kapalı bir sistem - bir buhar radyatöründe olduğu gibi çevresiyle enerji alışverişi yapabildiği ancak madde alışverişi yapamadığı zaman;
- açık bir sistem - çevresiyle hem madde hem de enerji alışverişi yapabildiğinde, örneğin kaynar su dolu bir kap.
Süreçler
Bir sistem, bir veya daha fazla özelliği (karakteristiği) değiştiğinde bir "süreç" geçirir. Bir süreç, durum değişikliği ile ilgilidir (bağlantılıdır). Sistemin sıcaklığı aynı kaldığında izotermal (aynı sıcaklıkta) bir süreç gerçekleşir. Sistemin basıncı aynı kaldığında izobarik (aynı basınç) bir süreç gerçekleşir. Adyabatik (ısı alışverişi olmayan) bir süreç, ısı hareket etmediğinde gerçekleşir.
İlgili sayfalar
- Termokimya alanında önemli yayınlar
- İzodesmik reaksiyon
- Maksimum çalışma prensibi
- Reaksiyon Kalorimetresi
- Thomsen-Berthelot prensibi
- Julius Thomsen
- Saf maddeler için termodinamik veri tabanları
- Kalorimetri
- Termal fizik
Sorular ve Yanıtlar
S: Termokimya nedir?
C: Termokimya, kimyasal reaksiyonlar ve fiziksel dönüşümlerle ilgili enerji ve ısının incelenmesidir.
S: Fiziksel dönüşümlerin bazı örnekleri nelerdir?
C: Fiziksel dönüşümlere örnek olarak erime (bir katının sıvıya dönüşmesi) ve kaynama (bir sıvının sıvıya dönüşmesi) verilebilir.
S: Termokimya reaktan ve ürün miktarlarını tahmin etmeye nasıl yardımcı olur?
C: Termokimyacılar, belirli bir reaksiyon sırasında her zaman reaktan ve ürün miktarlarını tahmin etmek için entropi tayinleri de dahil olmak üzere verileri kullanırlar.
S: Endotermik reaksiyonlar elverişli midir yoksa elverişsiz midir?
C: Endotermik reaksiyonlar elverişsizdir.
S: Ekzotermik reaksiyonlar elverişli midir yoksa elverişsiz midir?
C: Ekzotermik reaksiyonlar olumludur.
S: Termokimya hangi kavramları birleştirir?
C: Termokimya, termodinamik kavramları ile kimyasal bağlar şeklindeki enerji fikrini birleştirir.
S: Termokimyacılar ne tür hesaplamalar yaparlar?
C: Termokimyacılar ısı kapasitesi, yanma ısısı, oluşum ısısı, entalpi, entropi, serbest enerji ve kalori gibi hesaplamalar yaparlar.
Ansiklopedi içinde ara